简介
格列齐特服用后可能出现低血糖反应(剂量使用不当可引起严重低血糖,甚至死亡),消化道反应(如轻度恶心、呕吐、上腹灼热感等),过敏反应(如皮疹、白细胞减少等),肝脏损害(黄疸、肝功能异常等)等不良反应。
妊娠期妇女,已明确诊断的1型糖尿病患者,2型糖尿病患者伴有酮症酸中毒、高血糖高渗性昏迷、严重烧伤、感染、外伤和重大手术等应激情况,肝、肾功能不全者,对磺胺类药过敏者,白细胞减少患者等均需禁用格列齐特。
格列齐特有片剂和胶囊剂两种剂型,部分剂型已列入医保,其常释制剂格列齐特片/分散片/胶囊为医保甲类,缓释制剂格列齐特缓释片/缓释胶囊为医保乙类,复方制剂二甲双胍格列齐特片未被列入医保。
医学用途
适应证
适用于在经饮食控制及体育锻炼疗效不满意的轻至中度2型糖尿病患者,其胰岛B细胞有一定的分泌胰岛素功能,无急性并发症(感染、创伤、急性心肌梗死、糖尿病酮症酸中毒、高血糖高渗性昏迷等),非妊娠期,无慢性肾功能不全。
用法与用量
格列齐特片:口服,开始一次80mg,可于早餐前服用;也可一次40mg,一日2次;如果需要增加剂量,一般一次80mg,早、晚餐前服用。2周后按疗效调整用量,需要时逐步增加。一般一日剂量为80~240mg,最大剂量一日不超过320mg。
格列齐特缓释片:口服,一日30mg,宜在早餐前一次性服用。若血糖水平控制不佳,可逐渐增加至一日60mg、90mg或120mg。最大剂量为一日不超过120mg。剂量的增加频率以间隔2~4周为宜。须整片吞服,不可嚼碎或掰开服用。
剂型与规格
格列齐特的剂型与规格药物名称 | 剂型 | 医保类型 | 规格(以C15H21N3O3S计) |
格列齐特片 | 片剂 | 甲类 | 80mg |
格列齐特分散片 | 片剂 | 甲类 | 40mg |
格列齐特胶囊 | 胶囊剂 | 甲类 | 40mg |
格列齐特缓释片 | 片剂 | 乙类 | 30mg、60mg |
格列齐特缓释胶囊 | 胶囊剂 | 乙类 | 30mg |
二甲双胍格列齐特片 | 片剂 | - | 格列齐特40mg,盐酸二甲双胍250mg |
药理机制
磺酰脲类对多数2型糖尿病患者有效。
主要作用为刺激胰岛B细胞分泌胰岛素,其作用机制是与B细胞膜上的磺酰脲受体特异性结合,从而使ATP依赖的K通道关闭,引起膜电位去极化,使Ca通道开启,胞液内Ca浓度升高,促使胰岛素分泌。
格列齐特可抑制血小板黏附及凝集,并有纤维蛋白溶解活性。
药代动力学
格列齐特片吸收较快,口服后2~6小时血药浓度达峰值,消除半衰期8~10小时,主要经肝代谢失去活性,第2天可由肾排出98%。经C标记研究其排泄物发现,60%~70%经尿液排出,10%~20%由粪便排出,其中尿排出者仅有5%为原形药物。格列齐特缓释片口服后,药物吸收完全,进食不影响其吸收的速度和吸收量。在起初的6小时内药物血浆浓度逐渐升高,6~12小时后达稳定状态。
风险与禁忌
不良反应
低血糖反应:其诱因常为进餐延迟、剧烈体力活动或药物剂量过大,尤其是长效制剂如格列本脲、氯磺丙脲以及合用某些可增加低血糖发生的药物(见"药物相互作用")。发生低血糖反应后,进食、饮糖水通常可缓解。在肝肾功能不全或老年、体弱者,若剂量偏大则可引起严重低血糖,甚至死亡。
消化道反应:部分品种有轻度恶心、呕吐、上腹灼热感、食欲缺乏、腹泻、口中金属味等,症状程度与剂量有关。部分患者可出现体重增加。
过敏反应:如皮疹,偶有发生剥脱性皮炎者;血液系统异常少见,包括白细胞减少、粒细胞缺乏症、贫血、血小板减少症。
肝脏损害:黄疸、肝功能异常偶见。
特殊人群用药
儿童用药:尚无资料。
妊娠期及哺乳期妇女:动物实验和临床观察证明磺酰脲类降血糖药物可造成死胎和胎儿畸形,故妊娠期妇女禁用。格列齐特可由乳汁排出,哺乳期妇女不宜应用,以免婴儿发生低血糖。
老年人用药:老年2型糖尿病患者开始宜采用小剂量、作用时间较短的制剂,以免发生严重低血糖反应。体质虚弱、高热、恶心和呕吐、肺功能或肾功能异常的老年人发生低血糖的可能性会增大应慎用。
禁忌证
下列情况应禁用:
已明确诊断的1型糖尿病患者。
2型糖尿病患者伴有酮症酸中毒、高血糖高渗性昏迷、严重烧伤、感染、外伤和重大手术等应激情况。
肝、肾功能不全者。
对磺胺类药过敏者。
白细胞减少的患者。
药物过量
格列齐特使用剂量偏大则可引起严重低血糖,甚至死亡。
注意事项
下列情况应慎用:有肾上腺皮质功能减退或垂体前叶功能减退症,尤其是未经激素替代治疗者。其患者发生严重低血糖的可能性增大。
用药期间应定期监测血糖、尿糖、尿酮体、尿蛋白和肝肾功能、血常规,并进行眼科检查。
药物相互作用
①抑制SU由尿中排泄,如治疗痛风的丙磺舒、别嘌醇。
②延缓SU的代谢,如酒精、H2受体拮抗药(西咪替丁、雷尼替丁)、氯霉素、抗真菌药(咪康唑)、抗凝药。磺酰脲类与酒精同服可引起腹痛、恶心、呕吐、头痛以及面部潮红(尤其是合用氯磺丙脲时);与香豆素类抗凝药合用时,开始两者血浆浓度皆升高,以后两者血浆浓度皆减少,故应按情况调整两药的用量。
③促使血浆白蛋白结合型SU游离的药物,如水杨酸盐、贝特类调脂药。
④药物本身具有致低血糖作用,如酒精、水杨酸类、胍乙啶、单胺氧化酶抑制药、奎尼丁。
⑤合用其他降血糖药物,如胰岛素、二甲双胍、阿卡波糖、胰岛素增敏药。
⑥β肾上腺素受体拮抗药可干扰低血糖时机体的升血糖反应,阻碍肝糖酵解,同时又可掩盖低血糖的神经警觉症状。
给药说明
饮食治疗是使用磺酰脲类药物的前提,如不控制饮食,药物不可能取得良好效果。
2型糖尿病患者应在医生指导下,在合理的生活方式及治疗的前提下,根据血糖状况逐渐增加剂量,直到血糖控制达到个体化的目标水平。
由于磺酰脲类药物的胃肠道反应较小,餐前服药效果较好。
漏服一次药物应尽快补上;如已接近下次用药时间,则不要加倍用药。
用药期间,要定期检查血糖或尿糖,在医生指导下调整剂量。
单独使用SU3个月血糖尚未达到控制目标时,可联合其他类型口服降糖药或胰岛素。
历史
20世纪40年代,在磺胺类抗菌药的临床应用中,发现伤寒患者在用磺胺异丙噻哒唑(IPTD)治疗后,感到乏力和头昏,甚至有的死亡,进一步研究发现服用这类药的患者都有不同程度的低血糖。通过动物实验证明磺胺异丙噻哒唑是通过促进胰岛释放胰岛素而产生这种副作用的,从而引起患者急性或持续性的低血糖。
对磺胺的这一作用进行较为深入的研究后发现,具有抗菌活性的磺酰脲类药物氨苯磺丁脲(carbutamide)具有更强的降血糖作用,氨苯磺丁脲成为第一个应用于临床的磺酰脲类降血糖药物,但由于其骨髓抑制作用及肝脏毒性而被限制使用。但后来陆续合成了约12000个磺酰脲类化合物,约有10个成为口服降血糖药物,统称为口服磺酰脲类降血糖药物。
根据被发现的时间顺序通常把磺酰脲类药物分为三代。第一代是20世纪50年代发现的,以甲苯磺丁脲为代表,这类药物可与胰岛β细胞表面的磺酰脲受体结合,刺激胰腺分泌胰岛素,但第一代药物由于作用时间长,低血糖风险大,在许多国家已经被限制使用。
第二代是20世纪70年代发现的,代表药物为格列本脲、格列吡嗪、格列齐特等,其中格列齐特于1967年合成并申请专利,第二代药物与第一代相比,与β细胞选择性结合能力显著加强,使用剂量较小,且引发低血糖、粒细胞减少症及心血管不良反应的概率较第一代低。
1987年施维雅与天津华津合作,共同引进格列齐特(达美康)。
使用情况
格列齐特作为二代磺脲类药物,疗效和安全性优于一代磺脲类药物,是磺脲类中唯一被WHO推荐为基础用药的促泌剂。格列齐特在国际上的用药经验已经超过40年,在中国也是临床使用时间长、被糖尿病患者广泛使用的口服降糖药物之一。1979年格列齐特普通片80mg在中国上市,2004年格列齐特缓释片30mg在中国上市,2011年格列齐特缓释片60mg进入中国市场。
格列齐特已列入中国基本药物目录和世界卫生组织基本药物清单。
化学信息
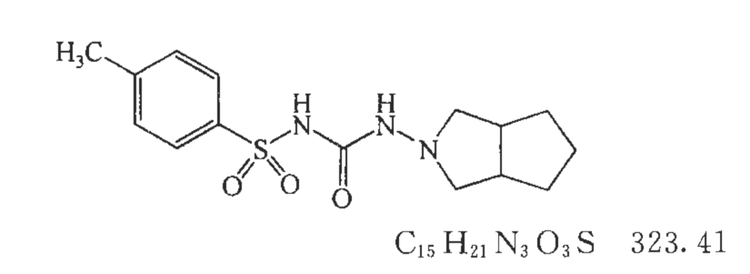
专利
格列齐特最早于1967年申请专利(公开号:US3501495A),专利持有人为SCIENCE UNION&CIE,专利已于1987年到期。